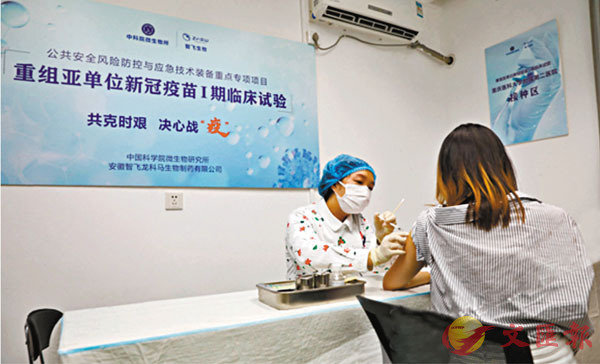
 ■ 為了評估新冠疫苗的安全性和免疫原性,從6月23日開始,在北京市、重慶市、湖南省相繼開展I、II期臨床試驗。圖為6月23日,重醫附二院,第一批參與重組亞單位新冠疫苗Ⅰ期臨床試驗受試者接種。 網上圖片
■ 為了評估新冠疫苗的安全性和免疫原性,從6月23日開始,在北京市、重慶市、湖南省相繼開展I、II期臨床試驗。圖為6月23日,重醫附二院,第一批參與重組亞單位新冠疫苗Ⅰ期臨床試驗受試者接種。 網上圖片產能高成本低具較強可及性 本月中起在國內外展開試驗
香港文匯報訊(記者 劉凝哲 北京報道)中國第五款進入III期臨床試驗的新冠候選疫苗日前出爐。安徽智飛龍科馬生物製藥有限公司(以下簡稱智飛龍科馬)和中科院微生物所聯合研製的「重組新型冠狀病毒疫苗(CHO 細胞)」18日在湖南省湘潭市湘潭縣開始國內部分的III期臨床試驗。本月下旬將首先在烏茲別克斯坦開始III期臨床試驗,印尼、巴基斯坦、厄瓜多爾也將陸續開始III期臨床試驗。
《科技日報》報道稱,上述疫苗於2020年6月19日獲批國家藥品監督管理總局的臨床試驗批件。為了評估新冠疫苗的安全性和免疫原性,從6月23日開始,在北京市、重慶市、湖南省三地招募18歲以上的健康成年人,相繼開展了隨機、雙盲、安慰劑對照的I、II期臨床試驗。
有很好安全性和免疫原性
據介紹,這款疫苗的技術路線為「重組亞單位疫苗」,是科技部部署的新冠疫苗「5條路線」之一。重組亞單位疫苗,也稱重組蛋白疫苗。中國科學院微生物研究所此前介紹,重組蛋白疫苗是通過基因工程的方式在工程細胞內表達純化病原體抗原蛋白,然後製備成疫苗。微生物所高福團隊和嚴景華團隊研發的這款新冠病毒疫苗的抗原是基於結構設計的S蛋白受體結構域(RBD)二聚體抗原,具有獨特的結構,不攜帶任何形式的外源標籤,具有自主知識產權。該疫苗通過工程化細胞株進行工業化生產,產能高,成本低,具有較強的可及性。
據報道,上述疫苗I、II期臨床試驗安全性和免疫原性關鍵數據顯示,具有很好的安全性和免疫原性,可開展下一步臨床試驗。III期臨床試驗在18周歲及以上人群中開展,採取隨機、雙盲、安慰劑對照的國際多中心臨床試驗,共計劃招募29,000人。11月18日,在湖南湘潭縣開始國內部分的III期臨床試驗,國外預計本月下旬將首先在烏茲別克斯坦開始III期臨床試驗,印尼、巴基斯坦、厄瓜多爾也將陸續開始III期臨床試驗。烏茲別克斯坦方面稱,這款疫苗已經被運送至該國,幾位中國專家也已到位,他們將負責監測志願者並培訓烏茲別克斯坦醫生。
年產可達3億劑1.5億人份
證券時報微信公眾號「時報新藥觀察」此前報道,國家衞健委醫藥衞生科技發展研究中心主任鄭忠偉認為,重組亞單位疫苗研發周期長,但應該是長期、規模化的首選。據了解,按現有產能計算,一旦獲批,智飛龍科馬的重組亞單位新冠疫苗年產能可達3億劑、1.5億人份。
世界衞生組織的統計也顯示,全球正在研究的各類新冠疫苗中,重組蛋白疫苗是數量最多的類型。重組蛋白疫苗技術為近些年疫苗開發的主要技術手段,目前市場上最為熱門的疫苗多為重組蛋白疫苗。中國在重組蛋白疫苗研發上已有多個成功經驗,2012年中國研製出世界上第一個戊型肝炎重組蛋白疫苗,2019年中國自主研製的人乳頭瘤病毒重組蛋白2價疫苗上市。

