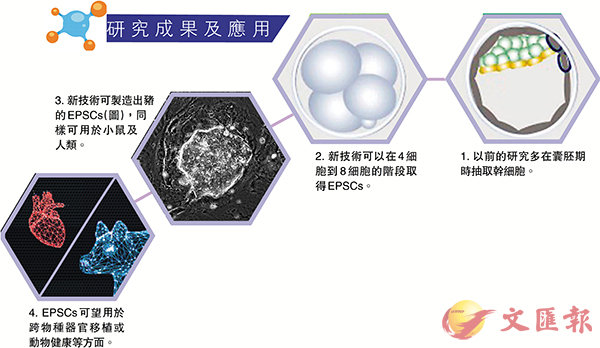
有關幹細胞的研究早於上世紀80年代初奠基,當時以小鼠為研究對象,科學家於胚胎發育至囊胚(Blastocyst ) 階段,首次成功提取胚胎幹細胞(ESC)並建立有關體系。劉澎濤團隊研究的核心問題,就是探討於更早的階段獲得新型超潛能幹細胞,最終成功在小鼠、人類、豬的受精卵分裂成4細胞、8細胞的極早期過程中,先後取得更加全能的擴展潛能幹細胞EPSCs。
在胚胎發育最早期,經歷了從單個受精卵到2細胞、4細胞、8細胞如此類推的分裂過程。1981年,諾貝爾生理及醫學獎得主Martin Evans首次成功於小鼠胚胎的囊胚, 即發育成大約100多個細胞的階段,成功獲得多功能的 ESC。至於人類的ESC則直至1998年才由另一科學家研究出來。
「中間之所以花這麼長時間,是由於小鼠和人在囊胚階段的胚胎分子機制已經很不一樣,從小鼠的幹細胞培養條件,放到人方面需時改進,結果足足花了17年始能克服」, 劉澎濤解釋,也因此過去多年來,只有很少數量的哺乳類動物能夠獲得胚胎幹細胞,豬的胚胎幹細胞更是一直做不出來。
於是他開始思考如何解決有關問題,過程間作出一項假設,就是需要在胚胎發育過程「再往前走」,從更早期的胚胎來建立幹細胞體系。「就像白紙一樣,愈發育到後面,紙就會畫上了愈多的圖案和字,而每個物種所畫所寫都不一樣」。他相信,愈早在哺乳類動物胚胎發育初期取得幹細胞,物種之間細胞運作的差異愈少,發育全能性更大,同時今後應用在多種哺乳類物種上的成功機率亦會更高。
所謂「一理通,百理明」,劉澎濤笑言自確立上述理論基礎以後,做得就比較快,找具體的實驗條件和材料都相對簡單。結果團隊2017年 底 成功建立了小鼠EPSCs體系,今年並進一步證明類似方法可用於人類和豬。
他進一步解釋說,以小鼠情況為例,一般是在4細胞到8細胞的階段取得EPSCs,「這都要比囊胚階段早多了,因囊胚是指約100到200個細胞階段」。惟他亦補充指,雖說「白紙」狀態是他們所追求的,但也不能過早,「太早的話就是受精卵,很多基因也還未激活,而只有在合子基因組激活後才能做,小鼠的情況是2細胞階段開始激活,豬和人則是4細胞到8細胞階段」,因此EPSCs已算是可應用的最早胚胎細胞。
此外,劉澎濤表示標準的ESC為多能幹細胞,幾乎可以產生所有在人身上能發現的細胞類型,但對身體之外的器官,例如是胎盤、羊膜這樣的細胞就不太能產生。相反,EPSCs屬全能幹細胞,分化潛能比ESC更高,包括可輕易大量產生胎盤滋養層細胞,「以前無法大量拿到,生育後胎盤已經非常老、無太多功能;用我們的幹細胞就能細緻的研究妊娠相關疾病,例如是妊高症,以研究其發病機理,尋求治療方法」,未來甚至可透過自身的EPSCs,產生各式各樣的本人細胞,達到治病效果。
整體而言,劉澎濤指EPSCs不止擁有的發育潛能更大,較ESC也更容易培養,相信EPSCs未來會有非常多在臨床方面的應用,但笑言這當然仍有漫長的研究之路。 ■香港文匯報記者 姜嘉軒

